斯克里普斯研究公司的科学家们开发了一种新策略来识别可以改变蛋白质功能的小分子,为发现靶向药物提供了一条有希望的途径。该小组与其他机构的科学家合作,使用他们的新方法来寻找可以改变与癌症有关的蛋白质活性的小分子。
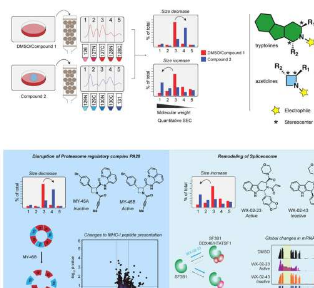
这项研究于20月<>日发表在《分子细胞》杂志上,改进了以前的方法,可以筛选小分子是否选择性地附着在蛋白质上,但不能筛选它们是否影响蛋白质的生物活性。新方法围绕着使用小分子的两个镜像版本,并比较它们如何改变细胞中蛋白质复合物的大小。
“小分子特异性结合蛋白质并引起生物学后果的能力是当今大多数药物的基本基础,”资深作者BenjaminCravatt博士说,他是斯克里普斯研究公司Glula化学生物学。“通过这种测定,我们正在扩大发现这些小分子的能力,这些小分子不仅结合蛋白质,而且具有功能影响。
近年来,Cravatt的实验室设计了几套小化学物质,可以不可逆地与蛋白质的某些部分结合。然而,筛选这些化学文库以发现它们对蛋白质功能的可能影响通常是一个缓慢而乏味的过程。由于单个蛋白质在细胞生物学中具有不同的作用,研究人员通常必须为每种感兴趣的蛋白质开发专门的功能筛选。例如,一个屏幕可以确定化学物质是否影响细胞生长,而另一个屏幕可以确定化学物质是否改变了不同分子的水平。
“仅仅因为小分子在物理上参与蛋白质并不意味着它会改变蛋白质在细胞中的功能,”共同第一作者JarrettRemsberg博士说,他在斯克里普斯研究公司的Cravatt实验室担任美国癌症协会博士后研究员。前研究生MichaelLazear博士和博士后研究员MartinJaeger博士也是该论文的第一作者。
在这项新工作中,Cravatt的小组使用蛋白质聚集成复合物作为其功能的代表。蛋白质通常通过与其他蛋白质结合来起作用-如果这种结合没有发生或如果它被诱导发生,则表明蛋白质的功能可能已经改变。
研究小组设计了成对的“镜像”分子,称为立体异构体,每个分子都可以以与以前的化学库相同的方式与蛋白质不可逆地结合。成对的立体异构体让他们确信每个小分子的影响是由于其独特的结构(如果只有一个版本的分子改变了蛋白质的功能,则可能是特异性和直接的相互作用)。
一旦他们将细胞暴露于成对的立体异构体中,他们使用一种称为尺寸排阻色谱的技术测试感兴趣的蛋白质是否处于不同大小的复合物中,其中蛋白质通过具有不同大小孔的珠子进行筛分。
为了展示这种方法的效用,研究人员筛选了一组小分子改变前列腺癌细胞中蛋白质复合物大小的能力。他们确定了一种分子MY-1B,它选择性地破坏了一种称为PA28的蛋白质复合物,这种复合物以前被发现在降解癌症中的蛋白质中发挥作用。在白血病细胞中的进一步工作证实,通过特异性结合蛋白PMSE1,MY-1B或相关化合物(但不是它们的镜像)可以有效地灭活PA28复合物。
Cravatt及其同事还跟进了一项观察结果,即另一种化学物质EV-96改变了参与细胞内RNA链剪接的蛋白质复合物的大小。研究小组发现EV-96减缓了癌细胞的生长,并将SF3B1确定为化学物质结合的蛋白质。
在这两种情况下,新化学物质都代表了科学家首次能够用小而简单的合成化学物质靶向蛋白质复合物-PA28和所谓的剪接体。
“这意味着研究人员在他们的武器库中拥有他们以前没有的新化学工具,”Remsberg说。“这是一个更好地了解这些蛋白质以及研究潜在治疗机会的机会。
该团队希望他们的方法可以扩展到使用复杂大小以外的其他功能读数,他们打算在未来使用它来研究不同的细胞类型。
“长期的想法是,我们可以使用这种方法来发现影响任何读数的化合物,”Cravatt说。“当然还有其他读数,我们希望将来能够看到。
 东方时讯网
东方时讯网