基因组中古老的休眠序列以意想不到的方式影响胚胎发育。哺乳动物基因组包含处于不死但大部分“无害”状态的逆转录病毒序列。一个国际研究小组最近发现,如果这些逆转录病毒基因片段中的一些被释放,它们将如何影响胚胎细胞。出乎意料的是,不是病毒蛋白,而是遗传物质本身的拷贝在细胞中产生了不平衡。
经过几千年的进化,无数病毒已经嵌入我们的基因组中。惊人的百分之十的哺乳动物基因组由古老的逆转录病毒序列组成。这些似乎不再构成任何危险,因为它们中的大多数已经变异得面目全非。此外,这些基因已被细胞表观遗传沉默。但随着病毒遗体的沉默失败,它们将从坟墓中复活,导致牢房混乱。
“我们发现一些病毒基因的信使拷贝,即RNA,对胚胎细胞有重要影响,”柏林马克斯普朗克分子遗传学研究所(MPIMG)研究组组长DenesHnisz说。“病毒序列似乎记得它们劫持确保信息从DNA到RNA再到蛋白质的信息流动的分子机制的最初使命。有趣的是,信使RNA本身似乎是负责的。”
Hnisz的团队和合作研究人员在《自然遗传学》杂志上发表了他们的研究结果。他们描述了复活病毒的RNA对从DNA读取信息的酶施加吸引力。胚胎细胞的任务——例如读取重要的胚胎基因——被忽视了,导致了致命的失衡。例如,这种释放状态发生在某些类型的癌症和神经系统疾病中。
病毒是巧妙构造的遗传信息片段。其中一些将自己整合到宿主的基因组中并持续存在。数以千计的内源性逆转录病毒(ERV)拷贝已在整个哺乳动物基因组中传播,通常成群结队地存在数百个重复拷贝。
“随着逆转录病毒在其生命周期中从DNA的一个部分跳到下一个部分,它们可以改变基因,甚至重组它们。这使它们成为进化创造新基因的重要工具,”参与该研究的科学家之一亨利·尼斯卡宁(HenriNiskanen)说。研究。“然而,对于单个生物体而言,不受控制的基因修饰并不是好兆头,尤其是在胚胎发育过程中。”
这就是为什么细胞会识别ERV序列并将专门的镇压机制招募到它们的位置并让它们保持沉默。此外,染色体在这些位点被压缩。
但是如果你关闭这些保护机制会发生什么?研究小组想要找出当ERV僵尸不再受到控制时发生的第一件事是什么。为此,他们从小鼠的胚胎干细胞中去除了Trim28,一种负责沉默病毒残余物的蛋白质,并监测了直接后果。
一旦Trim28消失,细胞不出所料地读取更多ERV基因,在RNA聚合酶的帮助下产生RNA拷贝。但出乎意料的是,聚合酶同时从对干细胞效力特别重要的干细胞基因中消失了。
“每个细胞中只有有限的聚合酶和其他必需因子可用,”该团队的另一位研究员ChristinaRiemenschneider说。她说,如果同时转录的基因太多,它们就会争夺有限的资源。在一项实验中,重复的ERV序列与干细胞基因竞争。“我们发现ERV重复序列具有略高的亲和力——它们使机器远离胚胎基因,造成不平衡,”Riemenschneider说。
RNA聚合酶和其他选择性停靠在基因上的必要因子通常会聚集成含有大量蛋白质的液滴,并漂浮在细胞核中——很像沙拉酱中的油滴。这些“凝聚物”包含许多读取基因所必需的分子,它们特别容易被控制细胞中最重要基因的特定DNA片段所吸引。
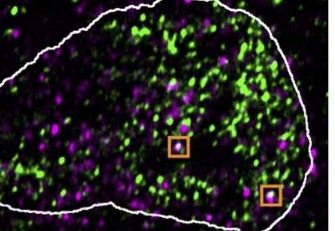
ERV基因,或者更确切地说,使用这些基因产生的RNA分子,似乎确实劫持了凝聚物。在高分辨率显微图像中,它们通常与重新激活的ERV基因位于相同的位置。从细胞中去除病毒RNA后,液滴会回到原来的位置。
病毒样RNA的作用不仅限于分子水平。研究小组在早期小鼠胚胎中工作,证明凝结物向ERV的转变对发育有不利影响。例如,干细胞失去了能够发育成任何其他细胞的典型特性,因为必要的基因不再活跃。
“非编码、非功能性基因通过RNA产生如此深远的影响,这一点非常了不起,”参与这项工作的科学家AbhishekSampathKumar说。“当想到整合到基因组中的逆转录病毒时,你可能会想到DNA损伤或病毒颗粒,但在这种情况下情况并非如此。”
因此,科学家团队表示,他们的发现使对内源性逆转录病毒的研究有了新的认识。“ERV及其RNA劫持转录凝聚物是一个重要的机制发现,在未来对转座因子及其表观遗传调节因子的研究中应该考虑到这一点,”参与这项研究的研究员VahidAsimi说。“这可能是ERV用于促进进化创新的另一条路线。”
“ERV的重新激活显然与病理有关,从肥胖到各种癌症,再到神经系统疾病,如肌萎缩侧索硬化和精神分裂症,”小组负责人DenesHnisz补充道。“希望我们的研究将有助于阐明这些疾病的分子原因。”
 东方时讯网
东方时讯网